近日,我校理学院陆涛教授、陈亚东教授、朱雍副教授研究团队在药物化学领域顶尖期刊《Journal of Medicinal Chemistry》(《药物化学杂志》)上发表了题为“Structure-Guided Optimization of 2-Aminoquinazoline Hematopoietic Progenitor Kinase 1 Inhibitors for improved Oral Bioavailability and Snergistic Anti-tumor immunity”的最新研究成果。该研究通过创新药物设计策略,成功开发出具有协同增效作用的新型免疫治疗候选药物,为克服当前肿瘤免疫治疗耐药性问题提供了重要解决方案。
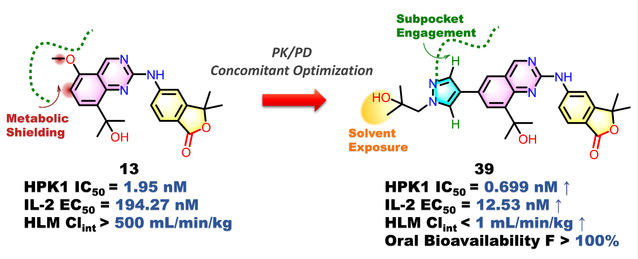
本项研究由理学院博士生万勃亨担任第一作者,在朱雍副教授、陈亚东教授和陆涛教授共同指导下,针对肿瘤免疫治疗领域的关键挑战——免疫检查点阻断疗法(ICB)的局限性展开研究。尽管ICB疗法在临床中显示出显著疗效,但其患者响应率偏低(10%~40%),且面临原发性耐药与获得性耐药难题,促使研究者探索联合治疗方案,其中小分子免疫调节剂被视为克服耐药性的重要联用伙伴。研究团队聚焦关键靶点造血祖细胞激酶1(HPK1),该因子通过抑制T细胞受体(TCR)信号通路及重塑肿瘤微环境中的免疫抑制网络,成为制约ICB疗效的核心因素。然而,现有HPK1抑制剂普遍存在效力、选择性与药代动力学特性难以平衡的问题,目前尚无药物获批上市。
通过创新性采用结构导向的位点修饰策略,研究团队成功实现药代动力学(PK)与药效学(PD)的同步优化。所开发的候选化合物39展现出显著优势:在活性方面,其对HPK1的半数抑制浓度(IC50)达到0.70 nM超高水平;选择性方面,在83种激酶谱筛选中对90%以上非靶标激酶保持超百倍选择性;药代特性方面,其人肝微粒体代谢稳定性(CLint <1 mL/min/kg)与口服生物利用度(小鼠模型F%达119%)均突破现有技术瓶颈。
动物实验显示,化合物39与抗PD-1抗体联用可显著增强T细胞功能,在体内模型中成功克服ICB耐药性,展现突出的协同抗肿瘤效应。该成果不仅为HPK1抑制剂的临床转化奠定重要基础,更为肿瘤免疫联合治疗提供了创新性解决方案,具有重要的临床转化价值。
文章链接:https://doi.org/10.1021/acs.jmedchem.5c00762
供稿单位:理学院 撰写人:钟凯宏
