近日,权威期刊Advanced Functional Materials在线发表了我校理学院钟文英教授团队的最新研究成果“Triple Enzyme-Regulated Molecular Hydrogels for Carrier-Free Delivery of Lonidamine”。钟文英教授和徐克明副研究员为本文的共同通讯作者,课题组2018级博士生吴灿为本文第一作者,中国药科大学为本文唯一通讯单位。论文链接:https://doi.org/10.1002/adfm.202104418。
肿瘤微环境中存在多种高表达的生物酶,这些酶对肿瘤的发生、发展和转移至关重要。由于广泛存在于癌细胞的多个细胞器,它们往往无法被小分子药物精准靶向。近年来,利用生物酶来调控超分子自组装,构建水凝胶载药体系,是肿瘤诊疗的新策略之一。其中,酶促自组装(Enzyme-Instructed Self-Assembly)可利用癌细胞高表达的碱性磷酸酶或其他蛋白酶,触发多肽小分子自组装形成纳米纤维,进而选择性杀死癌细胞。由于自组装多肽分子具有良好的靶向性和生物相容性,这类超分子水凝胶在肿瘤诊疗上备受关注。
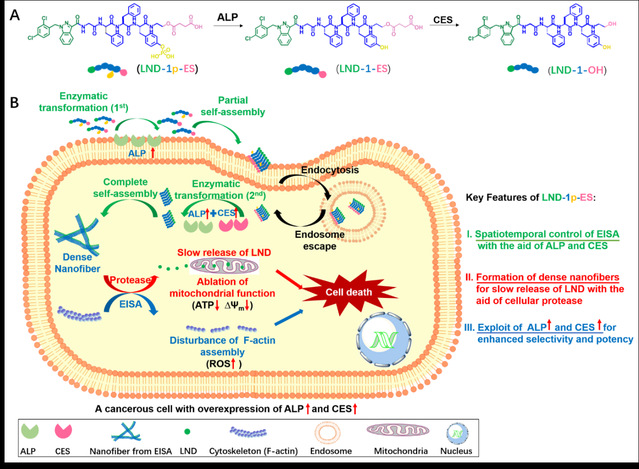
鉴于此,该团队设计了一种具有三酶响应性的自组装多肽分子LND-1p-ES,用于药物氯尼达明(Lonidamine,简称LND)的无载体递送。LND-1p-ES主要组成部分有:(i)LND作为头基,既可增强多肽的自组装能力,又能在胞内蛋白酶作用下缓慢释放纯药;(ii)Gly-Phe-Phe-Tyr序列,用于增强多肽序列的自组装能力;(iii)磷酸化酪氨酸部分,作为碱性磷酸酶(ALP)的底物;(iv)琥珀酸单酯部分,作为酯酶(CES)的底物。由于ALP位于细胞膜和细胞质,而CES主要位于细胞质,因此癌细胞高表达的ALP和CES可对LND-1p-ES的胞内自组装进行时空调控。细胞膜表面的ALP首先催化LND-1p-ES转化为LND-1-ES,触发初级自组装。之后,LND-1p-ES/LND-1-ES进入细胞质,在胞内ALP和CES共同作用下转化为凝胶因子LND-1-OH。后者在细胞内形成致密的纳米纤维网络,不仅能干扰肌动蛋白的组装、提高癌细胞的ROS水平,还可作为药物储库,在胞内蛋白酶的作用下缓慢释放LND,通过破坏线粒体功能诱导癌细胞死亡。
该研究的主要创新点:设计的LND-1p- ES分子集药物与载体于一体,并利用三酶时空调控其自组装过程,将LND前药选择性递送至癌细胞。与LND纯药、单酶响应性或无响应性对照水凝胶相比,LND-1p-ES水凝胶治疗组的体内外抗癌效果显著。此外,LND-1p-ES水凝胶在注射部位刺激性小,对小鼠主要器官的形貌无明显影响,表现出具有良好的生物相容性。该研究利用癌细胞高表达的多种生物酶来增强氯尼达明的抗癌效果,为多肽纳米材料的构建和药物递送提供了一种通用策略。未来,可利用病灶部位存在的其他信号分子,调控多肽-药物偶联分子的自组装行为,在疾病靶向的功能性软材料的开发上具有良好的应用前景。
该研究工作获得国家自然科学基金面上项目(编号:51973234,21775165),江苏省基础研究计划面上项目(编号:BK20191326)和中国药科大学双一流学科高原项目(编号:CPU2018GY25)等资助。
(供稿单位:理学院 撰写人:徐克明)
